Resumo: A pesquisa com seres humanos é antiga e sempre provocou polêmicas no que tange aos aspectos éticos. Nela está inserida a pesquisa clínica e, especialmente a que envolve novos medicamentos, vem crescendo muito em nosso país nos últimos dez anos, cujo desenvolvimento se deve, fundamentalmente, à Resolução nº 196, de 10 de outubro de 1996, do Conselho Nacional de Saúde. Após a Resolução 196/96, que tornou-se referência nacional e internacional no cenário da pesquisa envolvendo seres humanos, vieram outras que ajudaram a normatizar a pesquisa clínica no Brasil, assegurando a preservação dos interesses individuais e universais envolvidos. Este artigo tem como objetivo analisar as principais dessas normas à luz da Bioética.
Palavras-chave: pesquisa clínica – responsabilidade ética – normas – Bioética
Abstract: The research involving human subjects is old and always provoked polemics about ethical aspects. The clinical trial is inserted in this research e, especially that involve news medicines, it has been growing very much in our country in the last years, because Resolution nº 196, october 10th 1996, by National Council of Health. After this Resolution 196/96, that became nacional reference in the set of research envolving human subjects, resulted others rules that helped to normative trial clinical in Brazil, asserting the preservation of the individual and universal benefits involved. This article has objective to analyse the principal of these rules in point of view of the Bioethics.
Key Words: trial clinical – ethical responsability – rules – Bioethics
Sumário: 1Introdução – 2 Resoluções do Conselho Nacional de Saúde – 2.1 Resolução nº 196 de 10 de outubro de 1996: Panorama histórico de sua criação – 2.1.1 Resolução 196/96: Apresentação e Aplicabilidade – 2.2 Resolução nº 251 de 07 de agosto de 1997 – 2.3 Resolução nº 292 de 08 de julho de 1999 – 2.4 Resolução nº 346 de 13 de janeiro de 2005 – 2.5 Resolução nº 347 de 13 de janeiro de 2005 – 3 Resoluções e Portarias da Agência Nacional de Vigilância Sanitária / Ministério da Saúde – 4 A eficácia das normas – 5 Conclusão
1. Introdução
A experimentação com seres humanos é antiga e, segundo Vieira e Hossne, aceita-se como marco referencial do nascimento da experimentação científica o século XVI, com Galileu (apud Segre, Cohen, 1999: 159).
Os experimentos que mais marcaram a história foram na área biomédica, porém os seres humanos foram utilizados em experimentações de diversas áreas, tais como a psicologia, odontologia, nutrição, física, fisioterapia e outras. Vale dizer que a área biomédica é sempre a mais comentada e divulgada, por trazer repercussões na perspectiva de cura e prevenção de doenças, longevidade e sonho de imortalidade.
A pesquisa clínica está inserida na pesquisa que envolve seres humanos e pode ter como objetivo a pesquisa de novos medicamentos, novos procedimentos de diagnóstico e terapia, novas técnicas cirúrgicas e fisioterápicas, dentre outros estudos envolvendo seres humanos. Por ser a pesquisa com novos medicamentos a que vem ganhando maior destaque no nosso país, iremos tratar aqui especificamente dela e dos documentos normativos nacionais pertinentes ao tema. Para começar a falar sobre o assunto, definimos como ponto de partida o relato de três importantes experimentos, que marcaram a nossa história científica: a descoberta da vacina contra a varíola, que consistiu em colocar crostas de pústulas de varíola na mucosa nasal de pessoas sãs, inocular líquido da varíola bovina nas pessoas para torná-las imunes à doença, até chegar à inoculação da varíola humana no próprio ser humano, que resultou na descoberta da vacina; as primeiras pesquisas sobre a dengue utilizaram voluntários que eram civis que cumpriam penas na prisão estadual e muitos soldados americanos, em vista da dificuldade de se encontrar voluntários; vale destacar também o experimento sobre a poliomielite, que resultou em experimentar a vacina Salk, descoberta em 1950 nos Estados Unidos, em milhões de crianças, divididas em grupos tratado e de controle, sendo que as crianças do grupo controle recebiam soro fisiológico no lugar da vacina sem que os pais tivessem conhecimento (Hossne, Vieira, 1987).
Este ponto de partida nos leva a uma reflexão, defendida por Machado (1), de que não se deve fazer um julgamento ético retroativo, ou seja, é impossível tentar fazer uma análise ética atual sobre um caso concreto antigo, visto que são condutas contraditórias e até mesmo desastrosas.
“A experimentação com seres humanos tem sido feita ao longo dos séculos, com diferentes padrões de ética e de qualidade, em todo o mundo. De um lado, deve-se assegurar, por meio da experimentação, a aplicabilidade dos novos conhecimentos para o bem da humanidade e, de outro, devem-se criar mecanismos de salvaguarda para evitar os abusos da experimentação, a ‘cobaização’ do ser humano” (Hossne, Vieira, apud Segre, Cohen, 1999: 160).
O primeiro mecanismo de proteção do ser humano foi criado em 1947, logo após o julgamento dos crimes cometidos durante a Segunda Grande Guerra. Este documento, chamado de Código de Nüremberg, criou o que podemos denominar “os 10 mandamentos éticos da pesquisa envolvendo seres humanos”, nos quais, pela primeira vez na história, podemos observar responsabilidades e a presença dos referenciais da bioética (2) , conforme sintetizamos e destacamos os principais termos em negrito, conforme abaixo:
1. Obter o consentimento do voluntário, considerado legalmente capaz, sendo que o dever e a responsabilidade de garantir a qualidade do consentimento repousam sobre o pesquisador;
2. A pesquisa não pode ser feita de maneira casuística, devendo produzir resultados vantajosos para a sociedade (eis o referencial bioético da justiça);
3. Pesquisa prévia em animais e da evolução da doença;
4. Deve-se evitar o sofrimento e danos desnecessários ( eis o referencial da não-maleficência);
5. Quando houver risco de morte ou invalidez permanente, o próprio pesquisador deve submeter-se ao experimento;
6. O risco deve ser proporcional ao benefício (aqui notamos o referencial bioético da beneficência);
7. Proteger o participante de qualquer possibilidade de dano (eis o referencial do respeito à vulnerabilidade do sujeito de pesquisa);
8. O pesquisador e equipe devem ser cientificamente qualificados para a condução da pesquisa;
9. Garantir a liberdade do participante se retirar da pesquisa a qualquer momento (e não faltou o referencial bioético supremo da autonomia);
10. O pesquisador deve suspender a pesquisa, se houver possibilidade de dano ao participante.
Ao falarmos de responsabilidade ética faz-se necessário traçar um paralelo diferencial entre responsabilidade ética e responsabilidade civil, visto que no campo dos julgamentos fazemos menção às conseqüências esperadas e, dentre elas, não deixamos de pensar nas penalidades e aí entra a responsabilidade civil.
Para tanto, precisamos tentar responder o que é ética e o que é moral?
Ética, na concepção do Professor Hossne, é o juízo crítico de uma situação em conflito, ou seja vem de dentro pra fora, ao contrário de moral, que é um acordo social e vem de fora pra dentro, como por exemplo os códigos deontológicos.
Sabemos que ética não se confunde com moral, pois a moral é imposta e a ética é percebida. É certo, porém, que quanto mais evoluída for a sociedade menos esta se preocupará com a ética social, permitindo que cada indivíduo possa agir de acordo com sua ética pessoal. A ética, portanto, não se adquire com o nascimento, pois ela é a percepção do que é mais adequado num conflito entre a razão e a emoção (Segre, Cohen, 1999).
Mas, então, o que seria responsabilidade?
Responsabilidade, na definição de Muñoz e Almeida, é a capacidade de assumir todas as conseqüências dos seus próprios atos e omissões, e que, portanto, pode ser conceituada como a exata noção do dever (apud Segre, Cohen, 1999: 121).
A responsabilidade pode ser analisada no âmbito da ética e no âmbito jurídico e, neste último, portanto, mora a responsabilidade civil.
Encontramos no artigo 927, do Código Civil Brasileiro, uma fundamentação básica da responsabilidade civil, conforme segue in verbis:
“Aquele que, por ato ilícito (arts. 186 e 187), causar dano a outrem, fica obrigado a repará-lo.
Parágrafo único: Haverá obrigação de reparar o dano, independentemente de culpa, nos casos especificados em lei, ou quando a atividade normalmente desenvolvida pelo autor do dano implicar, por sua natureza, risco para os direitos de outrem.”
Podemos observar que, ao se cometer um ato ilícito que venha a causar dano a alguém, ficar-se-á obrigado a repará-lo, independendentemente de culpa e quando a natureza da atividade que causou o dano, por si só, implicar em risco para terceiros. Assim, as atividades de risco, como as desenvolvidas por um hospital e não menos por uma instituição que realize pesquisas com seres humanos, estarão obrigadas a reparar os danos que venham a cometer, independentemente de culpa e, aqui, podemos observar a teoria da responsabilidade objetiva.
Importante analisarmos também o artigo 186 citado:
“Aquele que, por ação ou omissão voluntária, negligência ou imprudência, violar direito e causar dano à outrem, ainda que exclusivamente moral, comete ato ilícito.”
Destacamos que não só por ação que se comete ato ilícito, mas por também por omissão, mesmo que o dano seja exclusivamente moral.
Com base nos conceitos ora expostos, vejamos agora a sua aplicação no cenário da pesquisa que envolve seres humanos.
Mas, o que é pesquisa com seres humanos? Quem é o patrocinador do estudo? Quem é o pesquisador? O que faz a instituição e qual o papel do Comitê de Ética em Pesquisa – CEP?
Em termos gerais e simplificados e dando enfoque aos sujeitos do título deste trabalho: pesquisador é quem faz o plano (projeto de pesquisa); a instituição oferece os meios para a realização do plano e responde pelos recursos oferecidos; o patrocinador pode também fazer o plano ou financiá-lo para que o pesquisador o execute. E o CEP, qual o papel do CEP nessa história? O CEP é quem aprova tudo isso e, ao aprovar o plano, ou melhor, o projeto de pesquisa, torna-se co-responsável pelos aspectos éticos, nos termos da Resolução 196/96 do Conselho Nacional de Saúde, hoje considerada o manual da pesquisa envolvendo seres humanos no Brasil e que conquistou o respeito nacional e internacional nesse assunto, conforme veremos adiante.
Vejamos, agora, algumas hipóteses meramente exemplificativas, envolvendo responsabilidades:
Exemplo 1: Um protocolo de estudo internacional chega num centro de pesquisas do Brasil, na versão original, e passa a ser traduzido pelo próprio pesquisador (executor da pesquisa). Como sabemos, todo protocolo tem um objeto e um objetivo que devem estar em conformidade com a Resolução 196/96. O projeto é analisado pelo CEP da instituição que, aprovado, é encaminhado à CONEP (3) que também o aprova. Assim, está pronto para ser iniciado, porém, o mesmo pesquisador que fez a tradução, altera a tradução do seu objeto no momento da execução da pesquisa e, em decorrência disso, 90 % dos sujeitos de pesquisa pioram ou adquirem a doença, e ocorrem 2 mortes. Pergunta-se: quais as principais responsabilidades envolvidas, com relação ao pesquisador e ao CEP neste caso?
Exemplo 2: um estudo duplo cego (4), no qual 2 sujeitos de pesquisa recebem a medicação nova e 3 recebem a medicação convencional. Passado algum tempo, os 2 que recebem a medicação nova estão vivos e apenas 1 que recebe a medicação convencional está vivo. Qual a responsabilidade do CEP neste caso?
E perante o sujeito de pesquisa, quem responde?
Para responder essas e outras perguntas é necessário conhecermos as normas existentes aplicáveis à pesquisa clínica envolvendo novos medicamentos.
2. Resoluções do Conselho Nacional de Saúde
Os documentos normativos seguintes não foram iniciativa do Poder Legislativo Brasileiro e, por isso, não apresentam roupagem de lei, no entanto, inegavelmente têm poder cogente e força de lei, muito embora emanadas pelo Poder Executivo, especificamente pelo Conselho Nacional de Saúde, órgão de controle social do Ministério da Saúde, sob a forma de Resolução Normativa e que merecem destaque no quesito eficácia.
2.1 Resolução nº 196 de 10 de outubro de 1996: Panorama histórico de sua criação
Já discorremos sobre a preocupação com a ética na experimentação com seres humanos, no final da Segunda Grande Guerra, após o julgamento em Nüremberg dos crimes contra humanidade, que deu origem ao Código de Nüremberg, em 1947, que foi o primeiro documento internacional a tratar do tema pesquisa com seres humanos. Logo depois, em 1964, veio a Declaração de Helsinque, com várias atualizações posteriores (1975, 1983, 1989. 1996, 2000 e 2003).
Surge, então, na década de setenta, diante do avanço científico e tecnológico que “trouxe consigo novos desafios para a experimentação de seres humanos não só no sentido individual, mas também no sentido de comunidade”, a necessidade de elaborar um novo documento internacional sobre o tema (VIEIRA e HOSSNE, apud COHEN e SEGRE, 1999, p. 161).
Dessa forma, surgiu o documento “Diretrizes Ética Internacionais para a Pesquisa Biomédica em Seres Humanos”, elaborada pela Organização Mundial de Saúde (OMS), em conjunto com o Conselho de Organizações Internacionais de Ciências Médicas (CIOMS), em 1981, que foi traduzido e editado pelo Ministério da Saúde do Brasil em 1985 e teve sua terceira versão publicada em português em 2002, pelas Edições Loyola.
Sob a influência deste contexto internacional, apesar de ter sido muito importante, porém pouco conhecida entre os pesquisadores, foi elaborada no Brasil, em 1988, a Resolução nº 1, pelo Conselho Nacional de Saúde, que estabelecia normas para a pesquisa em saúde. A propósito, em 1995 foi realizada uma pesquisa em Comitês de Ética em Pesquisa de 26 hospitais brasileiros que chegou a seguinte conclusão:
“Os resultados destes estudos demonstraram em primeiro lugar que é lamentável a forma como vem sendo realizada a pesquisa biomédica no Brasil, em relação aos parâmetros estabelecidos por normas nacionais e internacionais. Em segundo lugar, a necessidade de uma ampla divulgação das normas nacionais e internacionais de pesquisa em saúde, do papel dos Comitês de Ética em Pesquisa e a sua diferença com relação às Comissões de Ética Médica.” (KIPPER, OSELKA et al, 1995, p. 61-67)
A busca pelo aprimoramento das normas para pesquisa com seres humanos tornou-se, a partir daí, uma constante no meio científico brasileiro.
Após sete anos de aplicação da Resolução CNS nº 1/88 pela Comissão Intersetorial de Ciência e Tecnologia (CICT), o Conselho Nacional de Saúde decidiu pela revisão da Resolução nº 1/88, com os objetivos de atualizá-la e de preencher lacunas geradas pelo desenvolvimento científico. Foi, então, designado o Grupo de Trabalho, integrado por representantes de vários segmentos sociais e profissionais de diversas áreas, coordenado pelo Prof. William Saad Hossne, Conselheiro Titular representante da Sociedade Civil e da Comunidade Científica e Presidente da Sociedade Brasileira de Bioética à época (NUNES apud CONEP/MS, 2000, p. 7).
O processo de aprimoramento das normas para pesquisas envolvendo seres humanos, sob responsabilidade do Grupo Executivo de Trabalho designado pelo Conselho Nacional de Saúde, sendo os seus membros: William Saad Hossne, Sérgio Ibiapina Ferreira da Costa, Fátima Oliveira, Artur Custódio Moreira de Souza, Leocir Pessini, Simone Nogueira, Jorge Bermudez, Márcio Fabri dos Anjos, Marília Bernardes Marques, Álvaro Antônio da Silva Ferreira, Antonio Fernando Infantosi, Albanita Viana de Oliveira, Omilton Visconde, Roque Monteleone, Elisaldo Carlini (Secretário de Vigilância Sanitária/MS) e Corina Bontempo Duca de Freitas (CONEP, 2000, p. 11).
O processo foi extremamente complexo, amplo, coerente e representativo, pois divulgou informações através de cartas à comunidade civil, científica e de profissionais; consultou cientistas, pesquisadores, profissionais de diversas áreas, setores da bioética, conselhos de profissão, associações e entidades representativas de usuários do sistema de saúde, representantes do movimento de mulheres e instituições religiosas; revisou literatura e legislação brasileira e de diversos países, bem como teve o apoio de representantes da área jurídica e de direitos humanos; discutiu e debateu as opiniões e pontos de vista que retornaram das consultas, ganhando o apoio da indústria e de órgãos do Ministério da Saúde.
O resultado de todo esse trabalho não poderia ser melhor, pois deu origem, em 10 de outubro de 1996, à Resolução nº 196, que está em vigência há dez anos, e representa um verdadeiro manual da pesquisa com seres humanos, respeitada nacionalmente e elogiada internacionalmente.
Hossne e Freitas, Coordenador e Secretária Executiva do Grupo Executivo de Trabalho, respectivamente, fizeram um relato de trabalho na Série Cadernos Técnicos, do Conselho Nacional de Saúde e da Comissão Nacional de Ética em Pesquisa, publicada pelo Ministério da Saúde em 2000 (p. 17-21), da qual extraímos os trechos abaixo:
“Buscando a legitimação das propostas de modificações da Res. 01/88 e diante da necessidade de que estas refletissem os conceitos atuais de bioética, consideradas as perspectivas da sociedade como um todo, além da sua adequação à situação nos setores de ponta, responsáveis pela execução das pesquisas, foi definida uma metodologia de trabalho, conforme a Res. 173/95, que incluiu:
– ampla consulta à comunidade científica e à sociedade, solicitando análises e sugestões para aprimoramento da Res. 01/88;
– divulgação das Diretrizes Éticas Internacionais para Pesquisas Biomédicas Envolvendo Seres Humanos (CIOMS-OMS);
– estímulo à realização de seminários institucionais para discussão aprofundada do assunto;
– consolidação das propostas e apresentação em Audiência Pública;
– apresentação da proposta preliminar no Congresso Brasileiro de Bioética;
– apresentação final e aprovação no Conselho Nacional de Saúde.
Desta forma o grupo começou seu trabalho através de duas vertentes: consulta à sociedade e revisão cuidadosa da literatura.
Este processo, pioneiro no Brasil, com metodologia de ampla consulta, teve como primeira etapa a identificação de entidades e pessoas envolvidas com a pesquisa, a bioética e as políticas públicas, incluindo as associações científicas, universidades, instituições de pesquisa, entidades profissionais, entidades da sociedade civil da área de direitos humanos, direito sanitário, defesa do consumidor, movimentos de mulheres, associações de portadores de patologias, instituições religiosas entre outras. Procurou-se assim abranger representantes das áreas temáticas específicas: reprodução humana, genética, biossegurança, pesquisas envolvendo populações indígenas, equipamentos e dispositivos para a saúde, fámacos e medicamentos.
Foram encaminhadas 2.300 correspondências solicitando sugestões e enviando material básico para subsídio, incluindo a revista Bioética, publicada pelo Conselho Federal de Medicina, contendo as diretrizes nacionais e internacionais. O Informe Epidemiológico do SUS, edição de março de 1996, com distribuição de 20.000 exemplares, publicou também as diretrizes internacionais, a Res. CNS 01/88 e as Resoluções CNS 170 e 173 sobre o processo de revisão, solicitando sugestões.
Esta divulgação provocou o desencadeamento de discussões e do interesse de aprofundamento sobre bioética em diferentes grupos, talvez um dos resultados mais importantes do trabalho.
Seminários institucionais e locais foram realizados por várias entidades científicas e da sociedade civil, para organização de pontos de vista coletivos a respeito do tema. Algumas instituições definiram grupos de trabalho, para elaborar sugestões, entre elas a Escola Nacional de Saúde Pública/FIOCRUZ; a Secretaria de Saúde de Santa Catarina, que formou comissão com representação do Sindicato dos Médicos, do Conselho Regional de Odontologia e do Conselho Regional de Enfermagem do mesmo Estado; a Universidade de Brasília; a USP, especialmente o Hospital das Clínicas da FMUSP; o Hospital das Clínicas de Porto Alegre e vários Comitês de Ética Médica de Unidades de Saúde. O CNS participou de iniciativa locais de Oficinas e Seminários, também com o objetivo de recolher sugestões (…).
Também foi discutido o tema em encontro do Mercosul em São Paulo, em agosto/96, e em reunião da Sociedade Brasileira de Investigação Clínica, em 28/09/96.
Os membros do grupo mobilizaram seus pares visando incentivar as discussões e participaram de diversos eventos científicos que solicitaram apresentações sobre o tema bioética, tendo sido perceptível a mobilização da sociedade, inclusive através da imprensa.
Após esta primeira fase e com a análise das sugestões recolhidas nos eventos e nas 119 correspondências recebidas, muitas delas de grupos institucionais, correspondendo a um número considerável de pessoas, elaborou-se um documento preliminar, enviado novamente a um grande número de entidades e especialistas e apresentado em Audiência Pública, realizada em Brasília, no Ministério da Saúde, em 20/6/96. Nessa Audiência Pública, além das manifestações especialmente solicitadas de entidades tais como Associação Brasileira de Empresas de Biotecnologia (ABRABI), Federação Brasileira de Sociedades de Ginecologia e Obstetrícia (FEBRASGO), Associação Brasileira de Médicos Assessores de Indústria, Secretaria de Vigilância Sanitária do Ministério da Saúde, Sociedade Brasileira de Farmacologia Clínica, Superintendência de Cooperação Científica e Tecnológica do Ministério das Relações Exteriores, Ministério Público Federal e Comitê de Ética em Pesquisa do Hospital dos Servidores Públicos/IAMSPE.
A ética nas pesquisas foi também discutida no Congresso Brasileiro de Bioética, em São Paulo, de 26 a 28/06/96, e tema de uma mesa complementar na 10ª Conferência Nacional de Saúde, em setembro/96.
A revisão bibliográfica constou da análise da legislação de vários países da América Latina, EUA e Canadá, Comunidade Européia e organismos Internacionais, além da legislação brasileira correlata e bibliografia diversa com organização de banco de informações bastante extenso a ser disponibilizado no Centro de Documentação do MS. […]
Desta forma acredita-se que estas normas realmente são resultado do que pensa a sociedade brasileira, construída a partir dos requisitos do Ministério da Saúde/Governo, da comunidade científica, dos sujeitos da pesquisa e da sociedade como um todo, constituindo efetivo instrumento de concretização da cidadania e de defesa dos direitos humanos.”
Assim foi criada a Resolução 196/96 do Conselho Nacional de Saúde, cuja história de nascimento e criação serve de exemplo ao nosso Poder Legislativo e, certamente, lhe serviria de modelo de conduta para proceder necessárias reformas legais, como é o caso da reforma da legislação penal que carece esse país.
A Resolução 196/96 trouxe de forma simples e, ao mesmo tempo, completa, um manual operacional da pesquisa com seres humanos, contemplando os princípios, agora denominados referenciais básicos da bioética (5), sendo eles o da autonomia da pessoa, da não maleficência, da beneficência e o da justiça, condensando e fundindo de forma apropriada as disposições éticas dos três principais documentos que tratam da ética na pesquisa com seres humanos: Código de Nüremberg, Declaração de Helsinque e Diretrizes Éticas Internacionais para a Pesquisa Biomédica em Seres Humanos.
Com a Resolução 196/96 foi criada a Comissão de Ética em Pesquisa (CONEP), cuja finalidade e principais características veremos a seguir.
Acreditamos que o apoio da área jurídica no processo de sua elaboração foi fundamental, pois de maneira assertiva incluíram no seu corpo (preâmbulo) a fundamentação legal na qual se apóia e está em fiel cumprimento: a Constituição Federal, o Código Civil e Penal Brasileiro, o Estatuto da Criança e do Adolescente, o Código de Defesa do Consumidor e algumas leis federal relacionadas ao sistema de saúde pública. Tais disposições garantiram o poder cogente da Resolução 196/96, cuja força de lei é incontestável e extremamente eficaz, visto que o seu descumprimento pode acarretar em descumprimento de norma constitucional, civil, penal ou consumerista.
Enfim, a Resolução 196/96 é resultado de um trabalho planejado, fundamentado, eficiente e digno de elogios. É um marco na história da pesquisa envolvendo seres humanos do nosso país.
2.1.1 Resolução 196/96: Apresentação e aplicabilidade
A Resolução 196/96 apresenta dez capítulos, nos quais são tratados, respectivamente, do preâmbulo, dos termos e definições utilizados na pesquisa, dos aspectos éticos da pesquisa envolvendo seres humanos, do consentimento livre e esclarecido, dos riscos e benefícios, do protocolo da pesquisa, do Comitê de Ética em Pesquisa – CEP, da Comissão Nacional de Ética em Pesquisa – CONEP, da operacionalização e das disposições transitórias.
A ordem dos capítulos segue uma seqüência lógica de contextualização, que facilitam a compreensão e o entendimento.
Seguindo a ordem dos capítulos, faz-se necessário destacar no preâmbulo a alma jurídica que deu força de lei à Resolução 196/96, ou seja, quando disposto no preâmbulo que a Resolução “cumpre as disposições da Constituição da República Federativa do Brasil de 1988 e da legislação brasileira correlata: Código de Direitos do Consumidor, Código Civil e Código Penal, Estatuto da Criança e do Adolescente, Lei Orgânica da Saúde 8.080, de 19/09/90 (dispõe sobre as condições de atenção à saúde, a organização e o funcionamento dos serviços correspondentes), Lei 8.142, de 28/12/90 (participação da comunidade na gestão do Sistema Único de Saúde), Decreto 99.438, de 07/08/90 (organização e atribuições do Conselho Nacional de Saúde), Decreto 98.830, de 15/01/90 (coleta por estrangeiros de dados e materiais científicos no Brasil), Lei 8.489, de 18/11/92, e Decreto 879, de 22/07/93 (dispõem sobre retirada de tecidos, órgãos e outras partes do corpo humano com fins humanitários e científicos), Lei 8.501, de 30/11/92 (utilização de cadáver), Lei 8.974, de 05/01/95 (uso das técnicas de engenharia genética e liberação no meio ambiente de organismos geneticamente modificados), Lei 9.279, de 14/05/96 (regula direitos e obrigações relativos à propriedade industrial), e outras”, automaticamente garantiu-se a sua eficácia mediante o seu cumprimento integral, caso contrário estar-se-ia descumprindo a própria Constituição Federal, ou o Código Civil e Penal, ou uma lei federal, constituindo-se a infração em provável cometimento de crime ou ato ilícito, passível de processo judicial perante a vítima ou ao Ministério Público.
No Capítulo II são adotadas algumas definições, conforme foram extraídas da Resolução e seguem abaixo com negrito aos termos que, no nosso entendimento, merecem maior atenção :
II.1 – Pesquisa – classe de atividades cujo objetivo é desenvolver ou contribuir para o conhecimento generalizável. O conhecimento generalizável consiste em teorias, relações ou princípios ou no acúmulo de informações sobre as quais estão baseados, que possam ser corroborados por métodos científicos aceitos de observação e inferência.
II.2 – Pesquisa envolvendo seres humanos – pesquisa que, individual ou coletivamente, envolva o ser humano, de forma direta ou indireta, em sua totalidade ou partes dele, incluindo o manejo de informações ou materiais.
II.3 – Protocolo de Pesquisa – Documento contemplando a descrição da pesquisa em seus aspectos fundamentais, informações relativas ao sujeito da pesquisa, à qualificação dos pesquisadores e à todas as instâncias responsáveis.
II.4 – Pesquisador responsável – pessoa responsável pela coordenação e realização da pesquisa e pela integridade e bem-estar dos sujeitos da pesquisa.
II.5 – Instituição de pesquisa – organização, pública ou privada, legitimamente constituída e habilitada na qual são realizadas investigações científicas.
II.6 – Promotor – indivíduo ou instituição, responsável pela promoção da pesquisa.
II.7 – Patrocinador – pessoa física ou jurídica que apóia financeiramente a pesquisa.
II.8 – Risco da pesquisa – possibilidade de danos à dimensão física, psíquica, moral, intelectual, social, cultural ou espiritual do ser humano, em qualquer fase de uma pesquisa e dela decorrente.
II.9 – Dano associado ou decorrente da pesquisa – agravo imediato ou tardio, ao indivíduo ou à coletividade, com nexo causal comprovado, direto ou indireto, decorrente do estudo científico.
II.10 – Sujeito da pesquisa – é o(a) participante pesquisado(a), individual ou coletivamente, de caráter voluntário, vedada qualquer forma de remuneração.
II.11 – Consentimento livre e esclarecido – anuência do sujeito da pesquisa e/ou de seu representante legal, livre de vícios (simulação, fraude ou erro), dependência, subordinação ou intimidação, após explicação completa e pormenorizada sobre a natureza da pesquisa, seus objetivos, métodos, benefícios previstos, potenciais riscos e o incômodo que esta possa acarretar, formulada em um termo de consentimento, autorizando sua participação voluntária na pesquisa.
II.12 – Indenização – cobertura material, em reparação a dano imediato ou tardio, causado pela pesquisa ao ser humano a ela submetida.
II.13 – Ressarcimento – cobertura, em compensação, exclusiva de despesas decorrentes da participação do sujeito na pesquisa.
II.14 – Comitês de Ética em Pesquisa-CEP – colegiados interdisciplinares e independentes, com “munus público”, de caráter consultivo, deliberativo e educativo, criados para defender os interesses dos sujeitos da pesquisa em sua integridade e dignidade e para contribuir no desenvolvimento da pesquisa dentro de padrões éticos.
II.15 – Vulnerabilidade – refere-se a estado de pessoas ou grupos que, por quaisquer razões ou motivos, tenham a sua capacidade de autodeterminação reduzida, sobretudo no que se refere ao consentimento livre e esclarecido.
II.16 – Incapacidade – Refere-se ao possível sujeito da pesquisa que não tenha capacidade civil para dar o seu consentimento livre e esclarecido, devendo ser assistido ou representado, de acordo com a legislação brasileira vigente.
A Resolução traz em seu capítulo III, disposições sobre a eticidade na pesquisa envolvendo seres humanos, a qual definimos conforme o organograma abaixo:
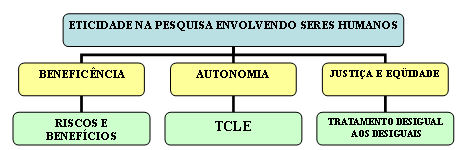
De acordo com a Resolução, a eticidade na pesquisa envolvendo seres humanos deve estar fundamentada em quatro referenciais da bioética que são: a beneficência, a autonomia da pessoa, a justiça e a eqüidade. O referencial da beneficência pode ser traduzido neste caso como a proporção razoável dos riscos e benefícios que a pesquisa deve respeitar, evitando riscos desnecessários ou que previsivelmente possam causar sérios prejuízos ao sujeito de pesquisa. Dessa forma, o benefício deve se sobrepor ao risco para que a pesquisa seja eticamente aprovada e desenvolvida. O respeito à autonomia da pessoa humana nada mais é que o fiel cumprimento da aplicação adequada do Termo de Consentimento Livre e Esclarecido, ou seja, a vontade e a liberdade de escolha e poder de decisão do voluntário da pesquisa jamais poderá ser subjugada. Os referenciais da justiça e da eqüidade completam a relação pesquisa e sujeito de pesquisa, uma vez que preconiza que toda pesquisa deve trazer resultados sócio-humanitários e que se revertam para a coletividade, além de orientar que os desiguais sejam tratados de maneira desigual, como por exemplo as comunidades indígenas, em vista da maior vulnerabilidade que representam.
Deste capítulo podemos também extrair os dez mandamentos éticos da pesquisa envolvendo seres humanos:
1. Adequar a pesquisa aos princípios científicos e obedecer a metodologia adequada;
2. Fundamentar a pesquisa na experimentação prévia com animais;
3. Aplicar o TCLE ao sujeito de pesquisa e garantir a privacidade e confidencialidade das informações;
4. Comunicar os resultados da pesquisa às autoridades sanitárias;
5. Garantir aos sujeitos da pesquisa os benefícios resultantes do projeto;
6. Respeitar os valores e costumes de comunidades, participantes do estudo;
7. Nas pesquisas internacionais, comprovar as vantagens aos sujeitos de pesquisa do Brasil;
8. Utilizar o material biológico e os dados coletados somente para a finalidade da pesquisa;
9. Considerar os riscos e benefícios quando a pesquisa for realizada em mulheres em idade fértil ou grávidas;
10. Descontinuar o estudo somente após parecer do CEP.
O capítulo IV da Resolução 196/96 trata do documento mais importante da pesquisa, o Termo de Consentimento Livre e Esclarecido – TCLE, que é o instrumento fundamental que dá início à pesquisa e pode ser definido conforme a tabela abaixo:
TCLE | |||||
INFORMAÇÃO | RESPEITO | LIBERDADE | APROVAÇÃO PELO CEP | ||
Linguagem acessível | Capacidades e deficiências | Entrada e saída do estudo | Assegurar a eticidade do documento | ||
A aplicação adequada do TCLE, portanto, requer quatro alicerces éticos:
a) levar informação e esclarecimentos ao sujeito de pesquisa, sobre o estudo que será realizado e do qual ele poderá ser participante, através de uma linguagem acessível e de fácil compreensão e que não cerceie a livre e espontânea vontade do sujeito de questionar e tirar suas dúvidas;
b) respeito às capacidades e deficiências do sujeito de pesquisa, especialmente em se tratando de grupos especiais, crianças e adolescentes, portadores de doença mental e sujeitos com diminuição de sua capacidade de consentir;
c) garantir a liberdade do sujeito optar pela sua participação na pesquisa, bem como a sua saída a qualquer momento, sem que isso lhe implique em quaisquer ônus;
d) todo TCLE deve ser aprovado previamente pelo CEP, tendo em vista garantir a eticidade do documento que será aplicado.
Estes quatro alicerces, por sua vez, devem estar fundamentados no sigilo e na confidencialidade dos dados dos sujeitos de pesquisa, como garantia do seu direito à privacidade.
A Resolução 196/96 também se preocupou com os riscos e benefícios envolvidos na pesquisa com seres humanos e cuidou de estabelecer que o benefício deve ser superior ao risco, ou no mínimo igual, bem como que a pesquisa deve ser imediatamente suspensa pelo pesquisador, ao verificar-se risco ou dano à saúde do participante voluntário, decorrente da pesquisa ou que não esteja previsto no termo de consentimento. A Resolução deixou explícito o direito à indenização ao sujeito de pesquisa, quando este vier a sofrer tipo de dano previsto ou não no termo de consentimento, além do direito à assistência integral.
O protocolo de pesquisa, segundo a Resolução, deve conter todas as informações sobre a pesquisa a ser realizada e sobre os sujeitos que poderão nele ser incluídos. É praticamente o “coração” da pesquisa, no qual o pesquisador e sua equipe vão pautar suas condutas e procedimentos.
O CEP e a CONEP, conforme já foi visto, têm papel fundamental na pesquisa, o de prevenir deslizes éticos e garantir os direitos dos sujeitos de pesquisa. Para isso a Resolução garantiu-lhes a autonomia e independência de trabalho.
A Resolução 196/96 inovou ao apresentar no seu capítulo IX recomendações operacionais, que garantem uma padronização de qualidade e forma.
Assim, diz que ao pesquisador cabe, in verbis:
a) apresentar o protocolo, devidamente instruído ao CEP, aguardando o pronunciamento deste, antes de iniciar a pesquisa;
b) desenvolver o projeto conforme delineado;
c) elaborar e apresentar os relatórios parciais e final;
d) apresentar dados solicitados pelo CEP, a qualquer momento;
e) manter em arquivo, sob sua guarda, por 5 anos, os dados da pesquisa, contendo fichas individuais e todos os demais documentos recomendados pelo CEP;
f) encaminhar os resultados para publicação, com os devidos créditos aos pesquisadores associados e ao pessoal técnico participante do projeto;
g) justificar, perante o CEP, interrupção do projeto ou a não publicação dos resultados.
Neste mesmo capítulo está previsto que o CEP deve estar registrado na CONEP e, ao aprovar um protocolo de pesquisa, passa a ser co-responsável pelos aspectos éticos da pesquisa.
Com relação à pesquisa com novos fármacos e medicamentos o CEP deverá encaminhar o protocolo à CONEP e, esta, por sua vez, encaminhará após parecer, à Secretaria de Vigilância Sanitária.
Por isso, veremos mais adiante a Resolução 251 do CNS e as normas da ANVISA, que tratam especificamente da pesquisa clínica.
2.2 Resolução nº 251 de 07 de agosto de 1997
A Resolução nº 251 do Conselho Nacional de Saúde aprova as normas de pesquisa envolvendo seres humanos para a área temática de pesquisa com novos fármacos, medicamentos, vacinas e testes diagnósticos, ou seja, é específica à pesquisa clínica.
Esta Resolução, de 7 de agosto de 1997, é complementar à Resolução 196/96 e ratifica, por sua vez, todas as suas disposições e reitera a questão do bem-estar e da dignidade do sujeito de pesquisa, que deverão prevalecer sobre quaisquer outros interesses.
Ela também traz um capítulo só para os termos e definições, nos quais estão inseridos: estudo fase I, estudo fase II, estudo fase III, estudo fase IV, farmacocinética, farmacodinâmica, margem de segurança e margem terapêutica, ressaltando que todos constam da Resolução do Grupo Mercado Comum (GMC nº 129/96).
Para efeitos diretos com o nosso trabalho, o capítulo que consideramos primordial é o capítulo III, que trata da responsabilidade do pesquisador, a qual é indelegável e instransferível, conforme prevê a Resolução 196/96. Dentre as responsabilidades do pesquisador, destacam-se a obrigação de apresentar o protocolo completo ao CEP, proceder a análise contínua dos resultados a fim de verificar o quanto antes os riscos e benefícios entre um tratamento e outro, comunicar os efeitos colaterais e reações adversas ao CEP e dar acesso aos resultados dos exames ao médico do paciente e ao próprio paciente sempre que solicitado.
A Resolução é minuciosa ao determinar os itens que compõe o protocolo e os detalha de forma objetiva no seu capítulo IV.
Ao prever as atribuições do CEP, a Resolução 251, de certa forma, reproduz o teor das já previstas na Resolução 196 e acrescenta a obrigação de aprovar a justificativa do uso do placebo e washout, convocar sujeitos da pesquisa para acompanhamento e avaliação, encaminhar os relatórios parciais e final à SVS, além da CONEP, bem como comunicar a mesma Secretaria sobre sindicância instaurada para averiguação de indícios de fraude, infringência ética, problemas de responsabilidade administrativa e ocorrência de eventos adversos graves.
Com relação à operacionalização, a Resolução 251/97 destaca, dentre as atribuições estabelecidas pela Resolução 196/96, as atividades de competência da CONEP e da SVS, que tem por fim assegurar a organização e normatização dos procedimentos.
2.3 Resolução nº 292 de 08 de julho de 1999
A Resolução 292/99 foi criada em virtude da necessidade de regulamentação complementar da Resolução 196/96, no que diz respeito à área temática especial “pesquisas coordenadas do exterior ou com participação estrangeira e pesquisas que envolvam remessa de material biológico para o exterior” (item VIII.4.c.8 da mesma Resolução).
De acordo com o disposto no capítulo I desta Resolução “são consideradas pesquisas coordenadas do exterior ou com participação estrangeira, as que envolvem, na sua promoção e/ou execução:
a) a colaboração de pessoas físicas ou jurídicas estrangeiras, sejam públicas ou privadas;
b) o envio e/ou recebimento de materiais biológicos oriundos do ser humano;
c) o envio e/ou recebimento de dados e informações coletadas para agregação nos resultados da pesquisa;
d) os estudos multicêntricos internacionais.”
São excluídas, por sua vez, desta definição “as pesquisa totalmente realizadas no país por pesquisador estrangeiro que pertença ao corpo técnico de entidade nacional e as pesquisas desenvolvidas por multinacional com sede no país.”
Entendemos que o ponto principal das disposições, dentro do nosso objetivo, é justamente o capítulo que prevê que “os ônus e benefícios advindos do processo de investigação e dos resultados da pesquisa devem ser distribuídos de forma justa entre as partes envolvidas, e devem estar explicitados no protocolo”, que garante o referencial bioético da justiça e da eqüidade. Além desta previsão, merece destaque a que estabelece que, “quando não estiver previsto o desenvolvimento do projeto no país de origem, a justificativa deve ser colocada no protocolo para apreciação do CEP da instituição brasileira”, ou seja, podemos verificar a preocupação com a preservação da dignidade dos brasileiros que, pela condição de viverem num país de terceiro mundo, podem estar em situação mais vulnerável do que estariam os sujeitos do país de origem da pesquisa.
A Resolução 292/99 é de extrema importância à pesquisa clínica, pois a sua maior parte é realizada com cooperação estrangeira, mediante financiamento de laboratórios farmacêuticos. Neste aspecto, o CEP é o instrumento que pode comedir as intenções ilimitadas advindas dos parceiros estrangeiros, que podem distanciar a pesquisa da ética.
2.4 Resolução nº 346 de 13 de janeiro de 2005
Nesta Resolução estabelece-se uma regulamentação para tramitação de projetos multicêntricos junto ao CEP e à CONEP.
Analisando esta regulamentação temos a nítida certeza de que o objetivo foi dar maior agilidade nos processos em trâmite de aprovação na CONEP, visto que ficou estabelecido que “será analisado pela CONEP apenas o primeiro protocolo, enviado por um dos centros. A listagem dos centros envolvidos deverá acompanhar o protocolo e o parecer consubstanciado do CEP. A CONEP, após terem sido atendidas eventuais pendências, enviará o parecer final a este CEP e aos demais centros envolvidos; o protocolo de pesquisa não aprovado na CONEP para o primeiro centro não poderá ser realizado em nenhum centro.”
Dessa forma, o sistema CEP-CONEP ganhou mais celeridade e proporcionou uma padronização entre os centros de pesquisa de um mesmo estudo.
2.5 Resolução nº 347 de 13 de janeiro de 2005
Mais um documento importante para a regulamentação da pesquisa envolvendo seres humanos, tendo em vista que a Resolução 347 aprovou diretrizes para análise ética de projetos de pesquisa que envolva armazenamento de materiais ou uso de materiais armazenados em pesquisas anteriores.
O ponto fundamental desta Resolução é a regulamentação do banco de material biológico, o qual ela previu da seguinte forma: “No caso de armazenamento e/ou formação do banco de material biológico no Exterior, deve ser obedecida à legislação vigente para remessa de material para o Exterior e ser apresentado o regulamento para análise do CEP quanto ao atendimento dos requisitos do item II”, que são: “definição dos responsáveis pela guarda e pela autorização de uso do material; mecanismos que garantam sigilo e respeito à confidencialidade (codificação); mecanismos que assegurem a possibilidade de contato com os doadores para fornecimento de informação de seu interesse (por exemplo, resultados de exames para acompanhamento clínico ou aconselhamento genético) ou para a obtenção de consentimento específico para uso em novo projeto de pesquisa”.
Prevê, ainda, que “o pesquisador e instituição brasileiros deverão ser considerados como cotistas do banco, com direito de acesso ao mesmo para futuras pesquisas. Dessa forma, o material armazenado não poderá ser considerado como propriedade exclusiva de país ou instituição depositária.”
Esta Resolução vem complementar com grande maestria, as Resoluções 196/96, 251/97 e 292/99, que são aplicáveis sobretudo à pesquisa clínica.
3. Resoluções e Portarias da Agência Nacional de Vigilância Sanitária / Ministério da Saúde
Como já pudemos observar, o processo de aprovação de uma pesquisa clínica, após a publicação da Resolução 196/96, deve obedecer uma estruturação de instâncias, responsáveis pela segurança e garantia dos direitos dos sujeitos de pesquisa, que são o CEP e a CONEP e, também, deve ser aprovada e autorizada pela Agência Nacional de Vigilância Sanitária (ANVISA), através da Gerência de Medicamentos Novos, Pesquisa e Ensaios Clínicos (GEPEC). Segundo Nishioka e Sá (2006), das competências atribuídas à GEPEC, destaca-se a análise e emissão de pareceres conclusivos nos processos referentes ao registro de medicamentos novos, bem como a autorização de projetos de pesquisa clínica a serem conduzidos em território nacional.
Sendo assim, algumas normas de pesquisa clínica são exaradas pela Agência Nacional de Vigilância Sanitária, através da GEPEC e, dentre elas, destacamos alguns documentos normativos importantes para a pesquisa clínica:
– Portaria nº 911, de 12 de novembro de 1998, que aprova e apresenta a relação de documentos necessários para instruir pedidos de autorização para iniciar a pesquisa clínica com fármacos, medicamentos, vacinas e testes diagnósticos novos;
– Resolução RDC nº 219, de 20 de setembro de 2004, que aprova o regulamento para elaboração de dossiê, a fim de obter comunicado especial (CE) para a realização de pesquisa clínica com medicamentos e produtos para a saúde;
– Resolução RDC nº 26 de 17 de dezembro de 1999, que normatiza a avaliação e aprovação de programas de acesso expandido, somente de produtos com estudos na fase III em desenvolvimento no Brasil ou no país de origem, e com programa de acesso expandido aprovado no país de origem, ou com registro do produto no país de origem.
Estas normas constituem uma evolução da ANVISA, que fora criada há tão pouco tempo, em 1999, e representam uma atividade que complementa a do CEP e da CONEP, trazendo grandes benefícios ao país, visto que a estrutura que hoje encontra-se em atuação no Brasil, faz com que a credibilidade do país como local de desenvolvimento de estudos clínicos o coloque em posição de destaque, perante a indústria farmacêutica nacional e internacional, favorecendo a expansão da pesquisa científica de qualidade.
4. A eficácia das normas
Com base nas normas existentes podemos retomar o exemplo 1 citado e afirmar que , no âmbito da responsabilidade ética podemos destacar que, de acordo com a Resolução 196/96, o CEP faz as regras que julgar ser necessárias para a condução do estudo e prevê as exigências para isso e, no nosso exemplo, o CEP não exigiu uma tradução juramentada para o protocolo, o que, na nossa opinião, foi uma falha de natureza ética, visto que deu margem a um fato desastroso. Ressaltamos que o protocolo sendo traduzido por um tradutor profissional incute neste uma responsabilidade pelo documento e, inegavelmente, uma imparcialidade total. O pesquisador, por sua vez, alterando o protocolo após aprovação do CEP e CONEP, atropelou os parâmetros éticos que devem existir em toda pesquisa e causou danos previsíveis aos participantes.
Já no âmbito da responsabilidade civil e também penal, basicamente poderíamos exigir do pesquisador a obrigação de reparar os danos cometidos por um ato ilícito, além de enquadrá-lo em alguns crimes, como falsificação de documento particular, lesão corporal por dolo eventual, dano qualificado e falsidade ideológica.
Retomando o exemplo 2 que citamos, caberia, certamente, uma intervenção do CEP imediata, através de uma análise interina dos dados da pesquisa, prevista na Resolução 251/97 do CNS, que deveria ter sido exigida no ato de aprovação do protocolo para esses casos de estudo duplo cego, em vista dos resultados previsíveis que ele pode trazer. Na dúvida, deve-se exigir a análise interina. Do contrário, baseados no nosso exemplo, em não havendo imediata intervenção do CEP, estar-se-ia contribuindo para o cometimento de um crime, no qual o patrocinador poderia responder culposamente e o patrocinador dolosamente.
E perante o sujeito de pesquisa, responderíamos com segurança que, na pesquisa envolvendo seres humanos, a instituição, o pesquisador e o patrocinador respondem solidariamente, conforme dispõe a Resolução 196/96:
“V.5 – O pesquisador, o patrocinador e a instituição devem assumir a responsabilidade de dar assistência integral às complicações e danos decorrentes dos riscos previstos.”
A Resolução 196/96, de 10 de outubro de 1996, prevê que a eticidade na pesquisa deve estar alicerçada em quatro referenciais da bioética: beneficência, que nada mais é do que a proporção razoável entre os riscos e benefícios, sendo que estes devem prevalecer; a autonomia, que se expressa, fundamentalmente, por meio do Termo de Consentimento Livre e Esclarecido; a justiça e a eqüidade, que preceituam que a pesquisa deve trazer benefícios sócio-humanitários e que os desiguais devem ser tratados de forma desigual e, neste aspecto, mencionamos a previsão contida no item VII.6 da Resolução, que exige a presença de um membro ad hoc no CEP, quando se tratar de pesquisa com grupos vulneráveis, comunidades e coletividades, tais como os indígenas.
Assim como no Código de Nüremberg, podemos também extrair da Resolução 196/96 10 mandamentos éticos, que devem nortear as pesquisas envolvendo seres humanos, sendo eles:
1. Adequar a pesquisa aos princípios científicos e obedecer a metodologia adequada;
2. Fundamentar a pesquisa na experimentação prévia com animais;
3. Aplicar o TCLE ao sujeito de pesquisa e garantir a privacidade e confidencialidade das informações;
4. Comunicar os resultados da pesquisa às autoridades sanitárias;
5. Garantir aos sujeitos da pesquisa os benefícios resultantes do projeto;
6. Respeitar os valores e costumes de comunidades, participantes do estudo;
7. Nas pesquisas internacionais, comprovar as vantagens aos sujeitos de pesquisa do Brasil;
8. Utilizar o material biológico e os dados coletados somente para a finalidade da pesquisa;
9. Considerar os riscos e benefícios quando a pesquisa for realizada em mulheres em idade fértil ou grávidas;
10. Descontinuar o estudo somente após parecer do CEP.
E perguntamos, como garantir que tais mandamentos éticos sejam cumpridos?
A Resolução 196/96 estabelece que o CEP deve ter caráter multi e transdisciplinar, deve garantir que os membros que estiverem, mesmo que indiretamente ligados a alguma pesquisa, fiquem isentos da tomada de qualquer decisão e, por fim, que as atividades realizadas pelo Comitê não sejam remuneradas. Tudo isso fundamentado na liberdade, autonomia e independência de trabalho.
Além do mais, a Resolução 196/96, enquanto em seu processo de elaboração, contou com um importante apoio de consultoria jurídica que, de maneira assertiva, incluiu em seu preâmbulo disposições legais que lhe garantiram a eficácia e força cogente que tem há dez anos, apesar de não ter natureza cartorial e de não ser propriamente lei:
“(…) Cumpre as disposições da Constituição da República Federativa do Brasil de 1988 e da legislação correlata: Código de Direitos do Consumidor, Código Civil e Código Penal, Estatuto da Criança e do Adolescente (…)”
Assim, previu-se que o descumprimento da Resolução pudesse implicar em descumprimento da própria Constituição Federal, do Código Civil e Penal e, portanto, sendo passível tal infração de processo judicial, garantindo-se, portanto, a força cogente que se espera de uma lei.
5. Conclusão
Com o sistema criado pela Resolução 196/96, mediante a estrutura da CONEP e dos CEPs, criou-se um sistema preventivo de deslizes éticos, com enfoque no planejamento, na conscientização, na prevenção do dolo e da culpa. A CONEP e os CEPs não têm papel de polícia ou de punição de infratores, cuja função fica para as autoridades competentes e, principalmente, para o Ministério Público. Com tal sistema preventivo, portanto, criou-se por derradeiro um sistema de garantia de direitos universais.
Assim, concluímos por dizer que as responsabilidades na pesquisa com seres humanos são muitas e, dependendo da situação concreta e do que se pretende aferir, são de natureza distinta, não se confundindo responsabilidade ética com responsabilidade civil. Os deveres existem, éticos e jurídicos, e convivem, porém não se confundem. Em qualquer julgamento que se faça e em qualquer atividade que se realize, não dá para estar ético. É preciso ser ético e fazer ética, e nem sempre devemos buscar as respostas nos chamados códigos de ética, pois, como diz o Professor Hossne, “nem tudo que não é proibido deve ser permitido” (6). Dessa forma, nem sempre encontraremos as respostas para nossos conflitos de valores numa lei ou código, mas, quiçá, dentro de cada um de nós e no limite da responsabilidade ética que todos nós temos perante o outro, para com a sociedade e a preservação da humanidade.
Informações Sobre o Autor
Viviane Hanshkov
Advogada. Especialista em Direito Empresarial. Mestranda em Bioética no Centro Universitário São Camilo.

